แอลไคน์ (ALKYNE)
แอลไคน์
เป็นสารประกอบไม่อิ่มตัว (Unsaturated Hydrocarbon) มี เป็นหมู่ฟังก์ชัน มุมพันธะ มีค่าประมาณ 180 oสารตัวแรกของแอลไคน์ คือ อะเซทิลีน หรืออีไทน์ (C2H2)
สูตรทั่วไป
|
CnH2n-2 เมื่อ n = 2,3,4……….
|
ตัวอย่างสารประกอบแอลไคน์
การเรียกชื่อแอลไคน์
ก. ระบบ Formula name คล้ายการเรียกชื่อแอลเคน แต่เปลี่ยนพยางค์ท้ายจาก ane เป็น yne
|
สูตรโมเลกุล
|
ชื่อ
|
|
C2H2
C3H4 C4H6 C5H8 C6H10 |
อีไทน์ (ethyne)
โพรไพน์( propyne) บิวไทน์( butyne) เพนไทน์( pentyne) เฮกไซน์( hexyne) |
ข. ระบบ IUPAC การเรียกชื่อแอลไคน์ตามระบบนี้ คล้ายกับการเรียกชื่อแอลคีนเพียงแต่เปลี่ยนพยางค์ท้าย ชื่อของโซ่หลัก จาก ene เป็น yne
สมบัติของแอลไคน์
สมบัติทางกายภาพ
1. แอลไคน์มีทั้งแก๊ส ของเหลว และของแข็ง
2. ไม่ละลายน้ำแต่สามารถละลายในตัวทำละลายอินทรีย์ หรือตัวทำละลายที่โมเลกุลไม่มีขั้วหรือมีสภาพขั้วน้อย เช่น อีเทอร์ เบนซีน คาร์บอนเตตระคลอไรด์ สารละลายไม่นำไฟฟ้า
3. มีจุดหลอมเหลว
จุดเดือดต่ำ แต่จะมีค่าสูงขึ้นเมื่อมวลโมเลกุลเพิ่มขี้น
จุดเดือด
จุดหลอมเหลวของแอลไคน์โซ่ตรงบางชนิด
|
จำนวนอะตอมของคาร์บอน
|
แอลไคน์
|
จุดหลอมเหลว
(oC) |
จุดเดือด
(oC) |
|
|
ชื่อ
|
สูตรโมเลกุล
|
|||
|
2
|
อีไทน์
|
C2H2
|
-80.8*
|
-84.0**
|
|
3
|
โพรไพน์
|
C3H4
|
-102.7
|
-23.2
|
|
4
|
1-บิวไทน์
|
C4H6
|
-125.7
|
8.0
|
|
5
|
1-เพนไทน์
|
C5H8
|
-105.7
|
40.2
|
|
6
|
1-เฮกไซน์
|
C6H10
|
-131.9
|
71.3
|
*จุดหลอมเหลวภายใต้ความดัน **อุณหภูมิที่เกิดการระเหิด
4. แอลไคน์มีจุดหลอมเหลว จุดเดือดสูงกว่าแอลคีนที่มีจำนวนคาร์บอนเท่ากันและลักษณะโครงสร้างทำนองเดียวกัน
(จุดเดือดแอลไคน์ > แอลเคน > แอลคีน )
สมบัติทางเคมี
1. มีความว่องไวในปฏิกิริยามากกว่าแอลคีน
เนื่องจากแอลไคน์มีความไม่อิ่มตัวมากกว่าแอลคีน
2. ติดไฟง่ายให้ CO2 ไอน้ำ และพลังงานและมีเขม่าเกิดขึ้นมากกว่าการเผาไหม้ของแอลคีน
3. เกิดปฏิกิริยาการเติมกับธาตุแฮโลเจนได้ ทั้งในที่สว่างและที่มืดและปฏิกิริยานี้จะเกิดได้ดีเมื่ออยู่ในตัวทำละลายที่โมเลกุลไม่มีขั้ว เช่น CCl4
4. ฟอกจางสี
KMnO4 ได้
4.1 กรณีแอลไคน์ที่มีพันธะสามอยู่ที่อะตอมของคาร์บอนตำแหน่งที่ 1 จะเกิดปฏิกิริยาดังสมการ
3RC=CH +
8KMnO4 + 4H2O → 3RCOOH + 3CO2 + 8MnO2 + 8KOH
4.2 แอลไคน์ที่มีพันธะสามอยู่ที่คาร์บอนตำแหน่งอื่น
เมื่อเกิดปฏิกิริยาจะเขียนสมการได้ดังนี้
5. เกิดปฏิกิริยาการเติมด้วย H2O
(hydration)
===>
6. เกิดปฏิกิริยาการเติมด้วย H2(hydrogenation)
===>
7. เกิดปฏิกิริยาการเติมด้วย HX
(addition of HXหรือ hydrogenhalogenation)
ประโยชน์ของแอลไคน์
อีไทน์ หรือ ชื่อสามัญว่าอะเซทิลีน(C2H2) มีสถานะเป็นแก๊ส เตรียมได้จากปฏิกิริยาระหว่างแคลเซียมคาร์ไบด์(CaC2)กับน้ำ
ใช้เป็นเชื้อเพลิงให้แสงสว่าง แก๊สนี้ผสมกับแก๊สออกซิเจนในอัตราส่วนพอเหมาะเมื่อติดไฟจะได้เปลวไฟ ออกซีอะเซทิลีนซึ่งให้ความร้อนสูงถึง 3000 ๐C ใช้ประโยชน์ในการเชื่อมและตัดโลหะ นอกจากนี้ยังใช้แก๊สอะเซทิลีนแทนแก๊สเอทิลีน(C2H4)เพื่อเร่งการออกดอกของพืชและเร่งให้ผลไม้สุกเร็วขึ้น ปฏิกิริยาการเตรียมอีไทน์เป็นดังสมการ
CaC2(s)
+ 2H2O(l) → HC=CH(g) + Ca(OH)2(aq)
ในอุตสาหกรรมเตรียมอีไทน์จากมีเทนโดยการให้ความร้อนสูงๆในระยะเวลาที่สั้นมากๆ
ปฏิกิริยาแสดงดังสมการ




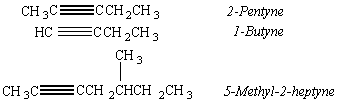









ไม่มีความคิดเห็น:
แสดงความคิดเห็น