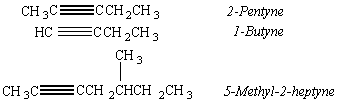สารอินทรีย์
วันเสาร์ที่ 16 กรกฎาคม พ.ศ. 2559
สารประกอบอะโรมาติก (Aromatic)
อะโรมาติก
|
สารประกอบอะโรเมติก
คือสารที่มีคาร์บอนต่อกันเป็นวง มีจานวน p อิเล็กตรอนเป็น 4n+2 เมื่อ n = 1, 2,
3 และอิเล็กตรอนเหล่านี้ไม่อยู่ประจาที่สารที่เราคุ้นเคยได้แก่
เบนซีน ซึ่งคาร์บอนทั้งหกอะตอมต่อกันเป็นหก
เหลี่ยมและคาร์บอนทุกๆ
อะตอมอยู่ในระบบเดี่ยวกันและมีจานวน 6 p อิเล็กตรอน แต่อะตอมของคาร์บอนมี
ไฮโดรเจนเกาะอยู่หนึ่งอะตอมพันธะระหว่างคาร์บอนกับคาร์บอนทุกพันธะเหมือนกันทุกประการ
เบนซีน (benzene) และอนุพันธ์ของเบนซีน
ในปี ค.ศ. 1825 Michael Faraday ได้แยกสารตัวอย่างออกจากก๊าซที่ได้จากการจุดไฟให้แสงสว่าง
ต่อมาเรียกว่า เบนซีน
เนื่องจากสามารถสังเคราะห์ได้จากการกลั่นกรดเบนโซอิกกับแคลเซียมออกไซด์
นับเป็นตัวอย่างของสารอะโรมาติกตัวแรก ต่อมาในปี ค.ศ 1834 ได้ค้นพบสูตรโมเลกุลของเบนซีนเป็น
C6H6 จากสูตรนี้แสดงให้เห็นว่าเบนซีนเป็นสารประกอบไม่อิ่มตัว
แต่ในขณะนั้นไม่มีผู้ใดเสนอสูตรโครงสร้างที่แท้จริงของเบนซีนว่าเป็นอย่างไร
จนกระทั่งในปี ค.ศ. 1865 Kekule ได้พยายามค้นคว้าและเสนอสูตรโครงสร้างของเบนซีน
โดยตั้งสมมติฐานว่าเบนซีนต้องประกอบด้วยวงรูปหกเหลี่ยมที่แบนราบมีคาร์บอน 6
อะตอมต่อกันด้วยพันธะเดี่ยวและคาร์บอนแต่ละอะตอมต่างก็สร้างพันธะกับไฮโดรเจน
1 อะตอม
จากการศึกษาโครงสร้างของเบนซีนพบว่าความยาวพันธะระหว่างคาร์บอนอะตอมทุกพันธะมีความยาวเท่ากันคือ
1.39 อังสตรอม (A) ซึ่งเป็นค่าที่อยู่ระหว่างคาร์บอนอะตอมพันธะคู่
(1.34 A) และพันธะสาม (1.54 A) นั่นหมายความว่าพันธะระหว่างคาร์บอนอะตอมในโมเลกุลของเบนซีนไม่ได้เป็นพันธะเดี่ยวหรือพันธะคู่อย่างใดอย่างหนึ่ง
แต่ประกอบด้วยพันธะคู่ที่มีการเคลื่อนที่ไปรอบวงจริง
และจากการวัดมุมระหว่างพันธะของคาร์บอนแต่ละอะตอมเป็น 120° นักวิทยาศาสตร์เรียกปรากฎการณ์ทานองนี้ว่า เรโซแนนซ์ (resonance) หมายถึงปรากฎการณ์ที่ไม่สามารถแสดงสูตรโครสร้างที่แท้จริงของสารได้
ดังนั้นจึงเขียนสูตรโครงสร้างอย่างย่อของเบนซีนได้ดังนี้
อนุพันธ์ของเบนซีน
เกิดจากไฮโดรเจนอะตอมในโมเลกุลของเบนซีนถูกแทนที่ด้วยธาตุใดธาตุหนึ่งหรือหมู่ธาตุใดหมู่ธาตุหนึ่ง
สารประกอบอะโรมาติกไฮโดรคาร์บอนที่เป็นอนุพันธ์ของเบนซีนจึงมีอยู่มากมายและการเรียกชื่อ
IUPAC ของอนุพันธ์เหล่านี้จะอ่านโดยใช้เบนซีนเป็นชื่อหลัก
ดังต่อไปนี้
1) ถ้าเบนซีนมีหมู่แทนที่เพียงหมู่เดียวให้อ่านหมู่แทนที่แล้วตามด้วยชื่อหลักเบนซีน
สารประกอบเหล่านี้โดยมากมีชื่อสามัญ
และบางครั้งชื่อสามัญมักนิยมเรียกมากกว่าชื่อ IUPAC เช่น phenol,
toluene เป็นต้น
2) ถ้าหมู่ที่ต่อกับเบนซีนเป็นหมู่ที่ซับซ้อนมากๆ
อาจจะเรียกชื่อเป็นสารประกอบของแอลเคนหรือแอลคีน หรืออื่น ๆ
แล้วเรียกเบนซีนเป็นหมู่แทนที่ ว่าเป็นหมู่ฟีนิล (phenyl group) เช่น
3) การระบุตาแหน่งทั้งสองที่หมู่เอทิลแทนที่อยู่อาจระบุเป็นตัวเลขก็ได้หรือที่สะดวกและนิยมมากกว่าคือใช้คานาหน้าว่า
ortho– สาหรับตาแหน่ง 1, 2 meta–สาหรับตาแหน่ง
1, 3 และ para–สาหรับตาแหน่ง 1,
4 แต่ถ้ามีหมู่แทนที่มากกว่า 2 หมู่ขึ้นไปจะระบุตาแหน่งที่แทนที่ด้วยตัวเลขอย่างปกติ
ถ้ามีวงอะโรมาติกมาเชื่อมต่อกันโดยมีด้านใดด้านหนึ่งร่วมกันเรียกว่าพอลินิวเคลียร์อะโรมาติกไฮโดรคาร์บอน
(polynuclear aromatic hydrocarbon ) เช่น
การเรียกชื่อสารประกอบโรเมติก
ถ้าเป็นกรณีที่มรหมู่ของอะตอมหรือหมู่ฟังก์ชันนัลเกาะอยู่เพียงหมู่เดี่ยว
มักจะเรียกหมู่ของอะตอมหรือหมู่ของฟังก์ชันนัลที่เกาะเบนซีนนั้นไว้ข้างหน้าและลงท้ายด้วยคาว่า
benzene ตัวอย่างเช่น
แต่ถ้ามีอะตอมหรือหมู่ของอะตอมสองหมู่เกาะกับเบนซีน
จะต้องระบุตาแหน่งที่เกาะกับเบนซีนด้วยซึ่งอาจจะระบุได้ 2 แบบ
1. ใช้คาว่า ortho
(o-) นาหน้าในกรณีที่ทั้งสอนอะตอมหรือหมู่เกาะอยู่กับอะตอมของคาร์บอนที่อยู่ติดกันในเบนซีน
ใช้คาว่า meta (m-) นาหน้าถ้าอะตอมหรือหมู่ของอะตอมเกาะอยู่กับอะตอมของคาร์บอนในเบนซีน
ที่มีคาร์บอนหนึ่งอะตอมคั่นอยู่ตรงกลางและใช้คาว่า para (p-) นาหน้ามนกรณีที่ทั้งสอนอะตอมหรือหมู่ของอะตอมนั้นเกาะอยู่กับอะตอมของคาร์บอนในเบนซีนที่มีคาร์บอนสองอะตอมคั่นอยู่ตรงกลาง
2. ใช้วิธีระบุตาแหน่งด้วยตัวเลข
โดยเริ่มนับคาร์บอนในเบนซีนที่มีอะตอมหรือหมู่ของอะตอมหนึ่งหนู่เกาะอยู่เป็นตาแหน่งที่
1 และวนไปตามวงของเบนซีนทางด้านที่ทาให้หมู่ที่สองเกาะอยู่มีเลขน้อยที่สุดและลงท้ายด้วยชื่อหลัก
ซึ่งชื่อหลักนี้จะขึ้นอยู่กับอะตอมหรือหมู่ของอะตอมที่เกาะอยู่กับคาร์บอนตาแหน่งที่
1 นิยมใช้วิธีนี้ในกรณีที่มีมากกว่าสอนหมู่เกาะอยู่กับเบนซีน
เช่น
ปฏิกิริยาของเบนซีน
เบนซีนมีสมบัติพิเศษคือมีโครงสร้างสามารถเรโซแนนซ์
(resonance) ทาให้โมเลกุลเสถียรมาก
พันธะคู่ของเบนซีนจึงแตกออกได้ยาก
ปฏิกิริยาเคมีของเบนซีน
ถึงแม้ว่าเบนซีนจะมีพันธะคู่อยู่ในโมเลกุลในทานองเดียวกับอัลคีนก็ตาม แต่จะไม่เกิดปฏิกิริยาการเติมแบบเดียวกับอัลคีน
กล่าวคือเบนซีนจะไม่ทาปฏิกิริยากับสารละลายโบรมีนในคาร์บอนเตตระคลอไรด์และสารละลายโพแทสเซียมเปอร์แมงกาเนต
เบนซีนจะเกิดปฏิกิริยาการแทนที่ด้วยอะตอมหรือหมู่ที่ไฮโดรเจนอะตอม เช่น
การแทนที่ด้วยแฮโลเจน
ปฏิกิริยาส่วนใหญ่ของเบนซีน ได้แก่
ปฏิกิริยาการแทนที่ชนิดอิเล็กโตรไฟลิก (electrophilic
substitution) ซึ่งต่างกับปฏิกิริยา
ของสารประกอบที่มีพันธะคู่อื่นๆ ซึ่งทาปฏิกิริยาการเพิ่ม
ก. ปฏิกิริยาการแทนที่ด้วยเฮโลเจน
สารประกอบอะโรเมติกทาปฏิกิริยากับเฮโลเจน
โดยมีเฟอร์ริกเฮไลด์ ซึ่งโดยเฮโลจะเป็นชนิดเดี่ยวกับเฮโลเจนตัวนั้นเป็นคะตะลิสต์
ได้สารประกอบเอริลเฮไลด์ปกติจะทาปฏิกิริยาเฉพาะกับคลอรีน
และโบรมีนเท่านั้นกลไกของปฏิกิริยาเป็นดังนี้
X2 + FeX3 ------- > X+ + FeX4-
Halonium ion
ข. ปฏิกิริยาการแทนที่ด้วยหมู่ไนโตร
สารประกอบอะโรเมติกทาปฏิกิริยากัยกรดไรตริกที่ผสมอยู่กับกรดซัลฟุริกได้สารประกอบไนโตร
กลไกของปฏิกิริยาเป็นดังนี้
HONO2 + 2H2SO4 --------------
------- --------------> NO2+ + H3O+ + 2HSO4-
nitronium ion
ค.
ปฏิกิริยาการแทนที่ด้วยหมู่อัลคิลหรือเอซิล
ปฏิกิริยานี้เรียกว่าปฏิกิริยาฟรีเดลคราฟท์ส
เป็นการเพิ่มหมู่อัลคิลหรือหมู่เอซิลให้กับเบนซีนโดยใช้อัลคิลและมีอะลูมิเนียมคลอไรด์เป็นคะตะลิสต์
ง.
ปฏิกิริยาการแทนที่ไฮโดรเจนในเบนซีนที่มีอะตอม
เมื่อเบนซีนมีอะตอมหรือหมู่ของอะตอมเกาะอยู่แล้วหนึ่งหมู่ซึ่งจะเรียกว่าหมู่ที่หนึ่งการแทนที่ไฮโดรเจนด้วยอะตอมหรือหมู่ของอะตอมอีกหมู่หนึ่งซึ่งจะเรียกว่าหมู่ที่สอง
มีข้อที่จะต้องพิจารณา 2 ข้อคือ
1. ตาแหน่งที่หมู่ที่สองจะเข้าเกาะกับเบนซีน
2. ปฏิกิริยาแทนที่ของหมู่ที่สองจะเกิดขึ้นได้ง่ายหรือยากกว่าหมู่ที่หนึ่งที่เกาะกับเบนซีน
จ. ปฏิกิริยาออกซิเดชันของอัลคิลเบนซีน
เบนซีนมีเสถียรภาพเพราะอิเล็กตรอนของพันธะ
p
ในเบนซีนอยู่ไม่ประจาที่ดังกล่าวแล้ว
เบนซีนจึงไม่ถูกออกซิไดส์ได้ซึ่งต้างกับอัลคีนแต่หมู่อัลคิลที่เกาะกับเบนซีนสามารถถูกออกซิไดส์จนถึงที่สุดได้เป็นกรดเบนโซอิก
ประโยชน์ของเบนซีนและอนุพันธ์
เบนซีนเป็นตัวทาละลายและเป็นสารตั้งต้นในการสังเคราะห์สารประกอบต่างๆ
แต่การสูดดมเบนซีนในปริมาณมากๆ
ทาให้เกิดอาการคลื่นเหียนและอาจถึงตายเนื่องจากระบบหายใจล้มเหลว
นอกจากนี้การที่ต้องสัมผัสกับเบนซีนต่อเนื่องกันนานๆ
จะทาให้ไขอ่อนในโพรงกระดูกซึ่งทาหน้าที่สร้างเม็ดเลือดถูกทาลาย
ดังนั้นห้องปฏิบัติการเกี่ยวกับเบนซีนจึงต้องมีระบบถ่ายเทอากาศอย่างดี
และถ้าไม่จาเป็นควรใช้โทลูอีนเป็นตัวทาละลายแทน
ในทางอุตสาหกรรมใช้โทลูอีนเป็นตัวทาละลายสาหรับแล็คเกอร์
ใช้ทาสี ยาและวัตถุระเบิด ส่วนไซลีนนิยมใช้เป็นตัวทาละลายสาหรับน้ามัน นอกจากนี้ยังใช้ทาความสะอาดสไลด์และเลนส์กล้องจุลทรรศน์
ใช้ไนโตรเบนซีนในการผลิตอนิลีน ซึ่งเป็นสารตั้งต้นในการผลิตสีย้อมและยาต่างๆ
ฟีนอลใช้ในการผลิตสีย้อม ยารักษาโรค พลาสติก
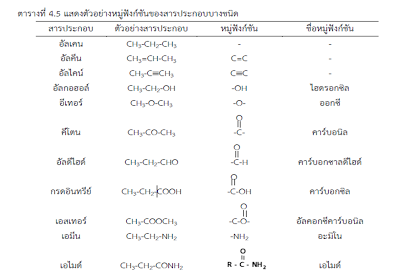
หมู่ฟังก์ชันหรือหมู่อะตอมที่แสดงสมบัติเฉพาะ
หมู่ฟังก์ชันคือหมู่ที่แสดงปฏิกิริยาเคมีของสารประกอบคาร์บอนนั้น
ๆ หรือปฏิกิริยาเคมีจะเกิดตรงบริเวณหมู่ฟังก์ชันของสารประกอบคาร์บอนนั้นๆ
วิธีพิจารณาหมู่ฟังก์ชันให้ถือว่าอัลเคนเป็นสารประกอบคาร์บอนที่ไม่มีหมู่ฟังก์ชัน
ส่วนที่แตกต่างไปจากอัลเคนให้ถือว่าเป็นหมู่ฟังก์ชัน เช่น
อัลคีนมีพันธะคู่ในโมเลกุล 1 พันธะ ที่เหลือเป็นพันธะเดี่ยวหมด ซึ่งพันธะเดี่ยวเหมือนอัลเคน ดังนั้น
บริเวณพันธะคู่จึงเป็นฟังก์ชันของอัลคีน
|
แอลไคน์ (ALKYNE)
แอลไคน์ (ALKYNE)
แอลไคน์
เป็นสารประกอบไม่อิ่มตัว (Unsaturated Hydrocarbon) มี เป็นหมู่ฟังก์ชัน มุมพันธะ มีค่าประมาณ 180 oสารตัวแรกของแอลไคน์ คือ อะเซทิลีน หรืออีไทน์ (C2H2)
สูตรทั่วไป
|
CnH2n-2 เมื่อ n = 2,3,4……….
|
ตัวอย่างสารประกอบแอลไคน์
การเรียกชื่อแอลไคน์
ก. ระบบ Formula name คล้ายการเรียกชื่อแอลเคน แต่เปลี่ยนพยางค์ท้ายจาก ane เป็น yne
|
สูตรโมเลกุล
|
ชื่อ
|
|
C2H2
C3H4 C4H6 C5H8 C6H10 |
อีไทน์ (ethyne)
โพรไพน์( propyne) บิวไทน์( butyne) เพนไทน์( pentyne) เฮกไซน์( hexyne) |
ข. ระบบ IUPAC การเรียกชื่อแอลไคน์ตามระบบนี้ คล้ายกับการเรียกชื่อแอลคีนเพียงแต่เปลี่ยนพยางค์ท้าย ชื่อของโซ่หลัก จาก ene เป็น yne
สมบัติของแอลไคน์
สมบัติทางกายภาพ
1. แอลไคน์มีทั้งแก๊ส ของเหลว และของแข็ง
2. ไม่ละลายน้ำแต่สามารถละลายในตัวทำละลายอินทรีย์ หรือตัวทำละลายที่โมเลกุลไม่มีขั้วหรือมีสภาพขั้วน้อย เช่น อีเทอร์ เบนซีน คาร์บอนเตตระคลอไรด์ สารละลายไม่นำไฟฟ้า
3. มีจุดหลอมเหลว
จุดเดือดต่ำ แต่จะมีค่าสูงขึ้นเมื่อมวลโมเลกุลเพิ่มขี้น
จุดเดือด
จุดหลอมเหลวของแอลไคน์โซ่ตรงบางชนิด
|
จำนวนอะตอมของคาร์บอน
|
แอลไคน์
|
จุดหลอมเหลว
(oC) |
จุดเดือด
(oC) |
|
|
ชื่อ
|
สูตรโมเลกุล
|
|||
|
2
|
อีไทน์
|
C2H2
|
-80.8*
|
-84.0**
|
|
3
|
โพรไพน์
|
C3H4
|
-102.7
|
-23.2
|
|
4
|
1-บิวไทน์
|
C4H6
|
-125.7
|
8.0
|
|
5
|
1-เพนไทน์
|
C5H8
|
-105.7
|
40.2
|
|
6
|
1-เฮกไซน์
|
C6H10
|
-131.9
|
71.3
|
*จุดหลอมเหลวภายใต้ความดัน **อุณหภูมิที่เกิดการระเหิด
4. แอลไคน์มีจุดหลอมเหลว จุดเดือดสูงกว่าแอลคีนที่มีจำนวนคาร์บอนเท่ากันและลักษณะโครงสร้างทำนองเดียวกัน
(จุดเดือดแอลไคน์ > แอลเคน > แอลคีน )
สมบัติทางเคมี
1. มีความว่องไวในปฏิกิริยามากกว่าแอลคีน
เนื่องจากแอลไคน์มีความไม่อิ่มตัวมากกว่าแอลคีน
2. ติดไฟง่ายให้ CO2 ไอน้ำ และพลังงานและมีเขม่าเกิดขึ้นมากกว่าการเผาไหม้ของแอลคีน
3. เกิดปฏิกิริยาการเติมกับธาตุแฮโลเจนได้ ทั้งในที่สว่างและที่มืดและปฏิกิริยานี้จะเกิดได้ดีเมื่ออยู่ในตัวทำละลายที่โมเลกุลไม่มีขั้ว เช่น CCl4
4. ฟอกจางสี
KMnO4 ได้
4.1 กรณีแอลไคน์ที่มีพันธะสามอยู่ที่อะตอมของคาร์บอนตำแหน่งที่ 1 จะเกิดปฏิกิริยาดังสมการ
3RC=CH +
8KMnO4 + 4H2O → 3RCOOH + 3CO2 + 8MnO2 + 8KOH
4.2 แอลไคน์ที่มีพันธะสามอยู่ที่คาร์บอนตำแหน่งอื่น
เมื่อเกิดปฏิกิริยาจะเขียนสมการได้ดังนี้
5. เกิดปฏิกิริยาการเติมด้วย H2O
(hydration)
===>
6. เกิดปฏิกิริยาการเติมด้วย H2(hydrogenation)
===>
7. เกิดปฏิกิริยาการเติมด้วย HX
(addition of HXหรือ hydrogenhalogenation)
ประโยชน์ของแอลไคน์
อีไทน์ หรือ ชื่อสามัญว่าอะเซทิลีน(C2H2) มีสถานะเป็นแก๊ส เตรียมได้จากปฏิกิริยาระหว่างแคลเซียมคาร์ไบด์(CaC2)กับน้ำ
ใช้เป็นเชื้อเพลิงให้แสงสว่าง แก๊สนี้ผสมกับแก๊สออกซิเจนในอัตราส่วนพอเหมาะเมื่อติดไฟจะได้เปลวไฟ ออกซีอะเซทิลีนซึ่งให้ความร้อนสูงถึง 3000 ๐C ใช้ประโยชน์ในการเชื่อมและตัดโลหะ นอกจากนี้ยังใช้แก๊สอะเซทิลีนแทนแก๊สเอทิลีน(C2H4)เพื่อเร่งการออกดอกของพืชและเร่งให้ผลไม้สุกเร็วขึ้น ปฏิกิริยาการเตรียมอีไทน์เป็นดังสมการ
CaC2(s)
+ 2H2O(l) → HC=CH(g) + Ca(OH)2(aq)
ในอุตสาหกรรมเตรียมอีไทน์จากมีเทนโดยการให้ความร้อนสูงๆในระยะเวลาที่สั้นมากๆ
ปฏิกิริยาแสดงดังสมการ
วันจันทร์ที่ 11 กรกฎาคม พ.ศ. 2559
สารประกอบ แอลกอฮอล์Alcohol
แอลกอฮอล์ ( ALCOHOL)
สารนี้จะมีหมู่ไฮดรอกซิล (-OH) เกาะอยู่ แบ่งได้เป็นสี่ประเภทตามชนิดของธาตุคาร์บอนที่หมู่ไฮดรอกซิลเกาะอยู่
AROMATIC ALCOHOL
การเรียกชื่อ
– ชื่อสามัญ : เรียกชื่อหมู่ที่มาเกาะ
ตามด้วยคำว่า alcohol
–
ชื่อ IUPAC : เรียกโดยอิงจาก alkane
โดยตัด e ออก แล้วเติม ol แทน และให้เริ่มนับตำแหน่งจากคาร์บอนฝั่งที่ใกล้หมู่ -OH มากที่สุด
– ชื่อสารประกอบ phenols : เป็นการเรียกแบบ Ortho,
Meta, Para ซึ่งศึกษาได้จากในบท สารประกอบ aromatic
สมบัติทางกายภาพ
– ละลายน้ำได้ เนื่องจากเป็นสารประกอบมีขั้ว เพราะเกิดพันธะไฮโดรเจนกับน้ำ
(เมื่อมีหมู่มาเกาะเยอะขึ้น การละลายจะลดลง)
– มีจุดเดือดสูงกว่าไฮโดรคาร์บอนและอีเธอร์ที่มวลโมเลกุลใกล้เคียงกัน
เนื่องจากแอลกอฮอล์เกิดพันธะไฮโดรเจนระหว่างโมเลกุลได้
การเตรียมแอลกอฮอล์
– Hydration
of Alkene : เติมน้ำลงไปในสารประกอบอัลคีน
ไฮโดรเจนไอออนและไฮดรอกไซด์ไอออนจะเข้าไปทำลายพันธะและเกาะกับคาร์บอนตามหลัก Markovnikov
– Reduction of Aldehyde ,
Ketone and Carboxylic Acid
*
ปฏิกิริยานี้ ไม่สามารถสังเคราะห์แอลกอฮอล์ตติยภูมิได้
ปฏิกิริยาของแอลกอฮอล์
– ปฏิกิริยาแสดงความเป็นกรด :
จะแสดงความเป็นกรดออกมาเมื่อทำไปทำปฏิกิริยากับเบสที่แก่มากๆ
โดยเรียงลำดับความว่องไวในการเกิดปฏิกิริยาได้ดังนี้
Methanol > ปฐมภูมิ
> ทุติยภูมิ > ตติยภูมิ
– ปฏิกิริยากับ Hydrogenhalide (HX); Hydrohalic acid : สามารถแยกความแตกต่างของแอลกอฮอล์แต่ละประเภทได้ นิยมใช้ HCl/ZnCl2
เรียกว่า Lucas Reagent และเรียกปฏิกิริยานี้ได้ว่า
Lucas’ Test
– Oxidation
Reaction
* แอลกอฮอล์ประเภท ตติยภูมิ จะไม่เกิดปฏิกิริยานี้
* ในการ ออกซิไดซ์ให้ได้ผลิตภัณฑ์เป็นแอลดีไฮด์นั้น ต้องใช้ reagent
ที่อ่อนๆ ไม่เช่นนั้นจะได้ผลิตภัณฑ์เป็น กรดอินทรีย์แทน
– Esterification
Reaction : เมื่อนำแอลกอฮอล์กับกรดอินทรีย์ไปต้มและใช้กรดเร่งปฏิกิริยา
จะได้ผลิตภัณฑ์เป็นเอสเทอร์ซึ่งเป็นสารที่มีกลิ่นเฉพาะตัว
– ปฏิกิริยาของฟีนอล : เนื่องจากฟีนอลเป็น Ortho
and Para directing group ดังนั้นหากเกิดปฏิกิริยา
สารอื่นที่มาเกาะจะเกาะที่ตำแหน่ง Ortho หรือ Para เท่านั้น
สมัครสมาชิก:
บทความ (Atom)